Study case of protein-peptide docking
我們一般常做的Docking case 有三種, 包括Protein-ligand docking、Protein-protein docking和Protein-peptide docking, 這次要向大家介紹一個Protein-peptide docking的實例。這是本核心所進行的客製化服務之一, 使用者在實驗的結果確實發現Protein和Peptide會反應作用, 但在未進行Mutation驗證的情況下, 希望我們提供電腦模擬的輔助說明, 支持實驗結果。
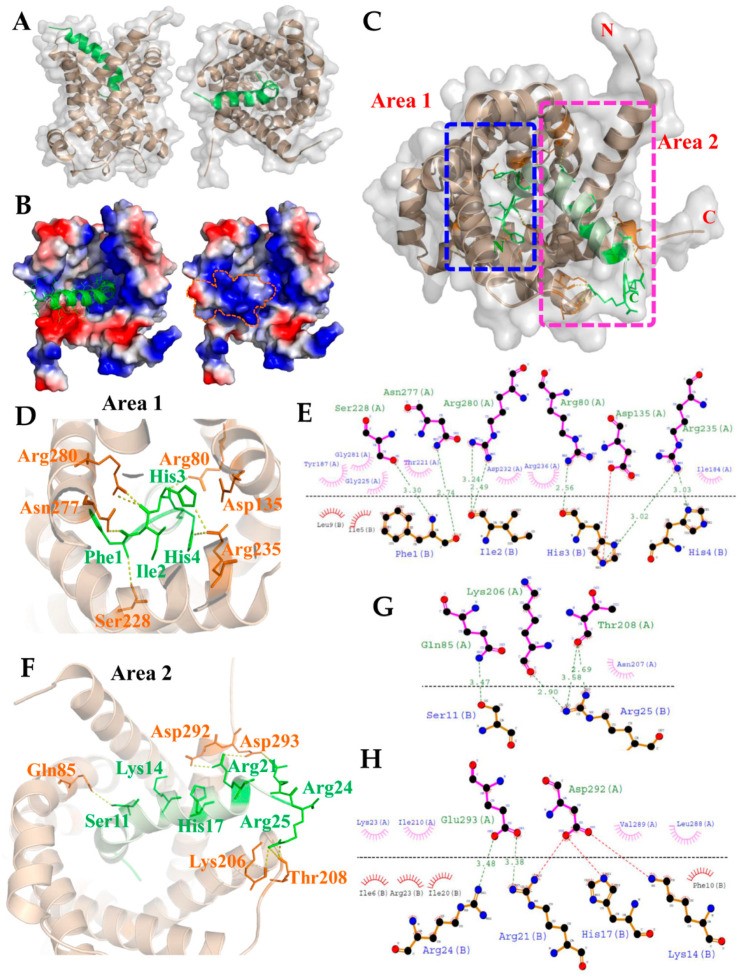
這個實驗的主題是Antimicrobial Peptide TP4 Targets Mitochondrial Adenine Nucleotide Translocator 2 (ANT2), Human ANT2是一個Transmembrane protein, 目前沒有實際結構被解出, 但可以利用源自於牛的ANT2 (PDB ID: 1OKC) 做為同源模擬(Homology modeling)結構的樣板, 兩者有89.2% Sequence identity和99% Query coverage; 抗菌肽TP4的長度是25 aa, 已有NMR解出的結構(PDB ID: 5H2S), 我們利用GRAMM-X docking server進行Protein-peptide docking模擬。
ANT2看起來是一個有深口袋Active site的結構, 口袋朝外擴張, 易捕獲ATP, 而在解出來的幾個ANT2結構中, 抑制劑(Inhibitor)都是緊密結合在口袋底部的RRRMMM motif上(這是跨物種高度保留的序列), 而且文獻顯示ADP/ATP轉運會因抑制劑的存在而受阻, 所以我們把Docking space設定在這個區域。
接下來我們要考慮的是, 所得到的Docking結果中, 到底是N端還是C端的Peptide插入口袋底部。藉由觀察蛋白質表面靜電勢(Electrostatic potential), 可以發現口袋底部主要是帶正電區域(包含RRRMMM motif), 而檢視TP4的序列, 可發現其C端帶正電, 故判斷TP4以N端插入口袋底部。(圖A-B)
ANT2和TP4間的交互作用分成口袋底部的Area 1和開口端的Area 2兩區域來討論, TP4 N端區域(Area 1)的Phe1、Ile2、His3、His4以氫鍵及疏水作用與口袋底部緊密結合; 在C端區域(Area 2), TP4除了與ANT2形成氫鍵和疏水相互作用外, TP4的Lys14、His17、Arg21和Arg24與ANT2的Asp292和Glu293之間可能形成鹽橋以加強結合與穩定結構。此外, 我們也呼應其LC-MS/MS分析鑑定的結果, 提出ANT2的三個殘基, 包括Arg80、Asn277和Arg280, 與TP4的Phe1、Ile2和His3有重要的氫鍵和疏水相互作用。(圖C-H)
在這項工作中, 我們以客觀合理的角度去輔助使用者討論與支援實驗結果闡述, 共同努力的成果也發表於Marine Drugs (2020)。
參考文獻:
Su BC, Liu YC, Ting CH, Lyu PC, Chen JY. Antimicrobial Peptide TP4 Targets Mitochondrial Adenine Nucleotide Translocator 2. Mar. Drugs. 2020, 18:417